A l’occasion d’Octobre rose
| A l’occasion d’Octobre rose, l’Institut Curie fait le point sur les recherches et les innovations qui permettent de mieux comprendre les cancers du sein et les origines de la maladie, c’est-à-dire les processus par lesquels une cellule normale se transforme en cellule cancéreuse puis en tumeur. Car comprendre les origines biologiques et génétiques des cancers du sein est essentiel pour innover et progresser dans la prise en charge. Les enjeux médicaux et humains relatifs à la connaissance de l’origine des cancers du sein et l’accompagnement proposé aux femmes. |
D’où vient mon cancer du sein, pourquoi moi, pourquoi maintenant ? » … des questions que se posent légitimement les patientes atteintes d’un cancer du sein.Avec plus de 60 000 nouveaux cas chaque année en France, le cancer du sein reste le premier cancer féminin et la première cause de décès par cancer.
Dans les laboratoires de l’Institut Curie, les chercheurs décortiquent les mécanismes biologiques, génétiques et épigénétiques qui entrent en jeu au moment où la tumeur se forme puis se développe. L’enjeu – de taille – est de bloquer les mécanismes le plus précocement possible. Décrypter la complexité de ces phénomènes requiert des recherches pluridisciplinaires, des technologies de pointe et des travaux innovants que les scientifiques de l’Institut Curie mènent de front pour apporter des réponses aux patientes et de futures solutions thérapeutiques.
Côté médical, tout est mis en œuvre pour accompagner les femmes, de l’annonce à l’après cancer, en leur proposant des consultations dédiées (annonce, psycho-oncologie…) pour les aider à faire face.
L’Institut Curie, 1er centre européen de lutte contre les cancers du sein, prend en charge chaque année plus de 7 000 femmes atteintes d’un cancer du sein dont plus de 3 000 nouvelles patientes.
« C’est tout l’intérêt de l’Institut Curie, explique le Pr Alain Puisieux, directeur du Centre de recherche de l’Institut Curie, les chercheurs sont au cœur des problématiques des médecins, donc des patientes. La question de l’origine des cancers les animent chaque jour. La compréhension des tous premiers évènements à l’origine du cancer est absolument primordiale car les enjeux et les perspectives sont considérables en matière de prévention, de diagnostic très précoce, avant même l’apparition des signes cliniques de la maladie, mais aussi de prise en charge thérapeutique pour nos patientes ».
Comprendre pour mettre au point les traitements de demain
dentifier l’origine du cancer de chaque patiente est un enjeu fort à l’Institut Curie. C’est une étape indispensable pour faire de la prévention, des diagnostics précoces, adapter les traitements et optimiser toujours plus les chances de guérison.

Une variété de facteurs exogènes et endogènes endommage constamment notre génome tout au long de la vie. Si notre organisme répare sans cesse notre ADN, parfois, les anomalies s’accumulent. Pour les cancers du sein, certains facteurs sont identifiés tels que l’exposition prolongée aux œstrogènes en lien avec une puberté précoce et une ménopause tardive ; la prise d’un traitement de la ménopause au-delà de 10 ans ; une obésité après la ménopause, ou bien l’alcool ; et enfin l’impact du vieillissement sur nos cellules. Le développement d’une cellule mammaire devient incontrôlé et un cancer du sein finit par apparaitre.
« Il existe une très grande variété de cancers du sein qui présente des caractéristiques différentes, du point de vue génétique, épigénétique et de leur micro-environnement ; ces caractéristiques influençant leur agressivité et leur réponse aux traitements…, explique le Pr Alain Puisieux. Cette variété est liée au fait que le développement d’un cancer est un processus dynamique à l’origine d’une grande complexité architecturale, avec des cellules cancéreuses qui évoluent progressivement du fait de la survenue de nouvelles mutations et de l’acquisition d’une plasticité cellulaire exacerbée leur permettant de changer d’identité en réponse aux stress qu’elles subissent. Les équipes de l’Institut Curie s’attachent à comprendre ces phénomènes dès les stades les plus précoces du développement d’un cancer. Mieux appréhender ces phénomènes permet en effet d’identifier de nouveaux points de vulnérabilité des cellules cancéreuses, ouvrant la voie à de nouvelles approches d’interception et de thérapies innovantes, notamment pour les cancers du sein de mauvais pronostic. »

Scruter l’origine et la diversité des cancers du sein pour personnaliser les traitements, tel est l’objectif du Dr Céline Vallot, cheffe d’équipe et directrice de recherche au CNRS, dont les travaux portent sur le rôle de l’épigénétique dans l’apparition du cancer du sein triple négatif et l’adaptation des cellules tumorales aux traitements anticancéreux.
« Avec mes collègues à l’Institut Curie, nous cherchons à établir les cartes d’identité épigénétiques de chacune des cellules, individuellement, dans une tumeur. Il s’agit d’établir les caractéristiques non pas de la séquence d’ADN elle-même mais des modifications autour de cette séquence qui influencent l’expression des gènes, explique le Dr Céline Vallot. Pour y parvenir, nous scrutons les cellules tumorales de la glande mammaire sous le prisme du « single cell » – ou analyse en cellule unique. Grâce à cette méthodologie d’une précision extrême, nous identifions aux stades les plus précoces les profils épigénétiques responsables de leur plasticité, à savoir leur transformation de cellules saines en cellules cancéreuses. In fine, certaines modifications épigénétiques pourraient nous permettre de développer de nouveaux outils diagnostiques ou d’identifier de nouvelles cibles thérapeutiques pertinentes pour le traitement du cancer du sein triple négatif. »
Quant aux travaux du Dr Raphaël Ceccaldi, qui viennent d’être publiés dans Nature, ils ouvrent la voie au développement de nouvelles cibles thérapeutiques. Près de la moitié des cancers du sein et de l’ovaire sont liés à la défaillance de systèmes biologiques qui réparent les cassures de l’ADN. Les chercheurs ont mis en évidence un mécanisme de réparation de l’ADN jusque-là inconnu impliquant une protéine, PolꝊ, capable d’agir pendant la division cellulaire. « Avec mon équipe à l’Institut Curie, nous scrutons les mécanismes que la cellule met en place pour réparer son ADN, permettant notamment la survie des cellules cancéreuses. C’est grâce à la compréhension de tels mécanismes que nous pouvons échafauder de nouvelles pistes pour déjouer le cancer, explique leDr Raphaël Ceccaldi, chargé de recherche à l’Inserm et chef d’équipe à l’Institut Curie. Nos découvertes sur le rôle et le fonctionnement de la polymérase théta dans le maintien de l’intégrité du génome nous laisse entrevoir des perspectives thérapeutiques nouvelles contre le cancer, notamment du sein et de l’ovaire. »
Oncogénétique : accompagner les femmes à haut risque
Une des expertises de l’Institut Curie internationalement reconnue est l’oncogénétique, c’est-à-dire la détection, la surveillance et la prise en charge des femmes à haut risque de cancers du sein d’origine héréditaire.
« 5 à 10% des cancers du sein sont diagnostiqués dans un contexte de prédispositions génétiques, explique la Pre Dominique Stoppa-Lyonnet, médecin, professeure de génétique à l’Université Paris-Cité. La recherche a mis en évidence plusieurs gènes de prédisposition aux cancers sein, dont les formes mutées, transmises dans certaines familles, confèrent un risque important de développer un cancer du sein aux femmes qui en sont porteuses. A l’Institut Curie, nous poursuivons les recherches sur les gènes de prédisposition et parallèlement nous recevons 2 500 femmes en consultation chaque année et réalisons 4 200 tests de prédisposition dont 1 700 pour des consultations d’autres établissements. »
Être au plus près des patientes à tous les stades de la prise en charge
« Les équipes de l’Institut Curie accompagnent les femmes à toutes les étapes : diagnostic, traitements (chirurgie, radiothérapie, traitements médicaux, essais cliniques…), reconstruction, accompagnement psychologique, prise en charge des effets secondaires, de la douleur, prévention, activité physique adaptée, nutrition, après cancer, retour au travail… » indique le Pr Steven Le Gouill, directeur de l’Ensemble hospitalier de l’Institut Curie.

Ce sont plus de 1 400 professionnels, médicaux et soignants, qui sont au plus près des femmes atteintes de cancer du sein sur les deux sites hospitaliers de l’Institut Curie.
« L’annonce du diagnostic est un grand bouleversement pour chacune d’elles. A quoi est dû leur cancer ? Pourquoi elles ? Pourquoi maintenant ? Cela fait partie des premières questions qu’elles se posent et nous posent en consultation », explique le Pr Le Gouill.
L’accompagnement des patientes dès l’annonce, une priorité
Les équipes de l’Institut Curie sont au plus près des patientes, en particulier dans le département de Soins de support (DISSPO) qui propose plusieurs consultations afin notamment de prendre en charge les femmes qui souhaiteraient disposer d’un soutien psychologique renforcé. Un dispositif d’annonce pionnier a par ailleurs été mis en place à l’Institut Curie dès 2005.
« Les infirmières sont au cœur du dispositif d’annonce, précise le Pr Le Gouill. Nous proposons un accompagnement adapté aux patientes dans leurs parcours de prise en charge. Nos soignants spécialement formés interviennent après une consultation médicale au cours de laquelle un diagnostic a été annoncé ou un plan de traitement proposé. L’annonce d’un diagnostic de cancer puis du plan de traitement génèrent un flot de questions alors que la patiente est souvent angoissée ou submergée par l’émotion ».
Ce sont des temps d’échanges dédiés et d’écoute active de la part de l’infirmière, avec une posture adaptée. Il s’agit essentiellement de vérifier ce que les patientes ont compris de l’annonce, de répondre à leurs questions. En même temps qu’elles s’assurent de la compréhension, les infirmières évaluent leurs besoins en soins de support pour éventuellement lui proposer de rencontrer l’assistante sociale, la diététicienne, la psychologue, le gériatre, l’addictologue…
Témoignage de Gwenaëlle, 44 ans
« Beaucoup de femmes dans ma famille ont été touchées par des cancers du sein ou des ovaires, ma mère et ma grand-mère en sont décédées. Je connaissais l’existence des prédispositions génétiques, notamment parce que je travaille dans le milieu médical, mais je n’avais pas été plus loin. Et puis, il y a un peu plus de 15 ans, ma grand-tante a initié des démarches pour réaliser une recherche de prédisposition familiale et une mutation sur le gène BRCA1 a été identifiée. Lorsque ma tante m’a proposé de l’accompagner à la restitution de son test, je n’ai pas hésité. C’est là que j’ai rencontré pour la première fois la Pre Dominique Stoppa-Lyonnet dans le service de génétique de l’Institut Curie. Ma tante n’était pas porteuse mais le médecin m’a demandé si je souhaitais faire le test. J’ai accepté et deux mois plus tard, le résultat est tombé, j’étais porteuse de l’altération sur BRCA2, j’avais 29 ans. Je savais que j’avais un risque sur 2 d’être porteuse alors je m’étais préparé à cette annonce. Je suis entrée ensuite dans le protocole « femmes à risque » de l’Institut Curie avec un suivi tous les ans. Dès lors, l’équipe du service de génétique m’a accompagné très régulièrement, avant et après ma seconde grossesse et plus tard dans mon choix d’annexectomie, c’est-à-dire l’ablation des ovaires et des trompes. Quant à mes enfants, ils connaissent mon parcours et je les encouragerais le moment venu à faire le test, ma fille est d’ores et déjà d’accord ».
La recherche sur tous les fronts contre les cancers du sein
Comprendre les origines biologiques et génétiques
Alcool, tabac, exposition prolongée aux oestrogènes, vieillissement, prédispositions héréditaires, mutations spontanées… une variété de facteurs exogènes et endogènes endommagent constamment notre génome. Si notre organisme répare sans cesse notre ADN, parfois, les anomalies s’accumulent, le développement d’une cellule mammaire devient incontrôlé et un cancer du sein finit par apparaitre. Plasticité cellulaire, épigénétique, défauts de réparation de l’ADN, perte de stabilité du génome… les domaines d’investigation scientifiques sont nombreux pour comprendre la tumorigénèse et décrypter l’origine et la multiplication des cellules tumorales. A l’Institut Curie, plus de 35 équipes de recherche pluridisciplinaires travaillent sur ces thématiques dont les enjeux sont cruciaux pour innover et progresser en matière de prévention, de diagnostic précoce, de prise en charge thérapeutique des patientes.
L’identité de la cellule initiatrice à l’origine du destin de la maladie
Quelle est cette cellule dans laquelle survient la tout première mutation ? Son « identité » régit-elle l’évolution des processus de cancérogénèse ? Comment parvient-elle à déjouer les premiers systèmes de sécurité de la cellule ? Les travaux du Pr Alain Puisieux, directeur du Centre de recherche de l’Institut Curie, ont mis en évidence que, dans la plupart des cancers du sein, cette cellule d’origine et les tout premiers évènements qui surviennent dans le processus de tumorigénèse sont absolument déterminants pour l’évolution de la maladie. En effet, en fonction de la cellule d’origine, les altérations n’auront pas les mêmes conséquences biologiques. Pour qu’un cancer se développe, cette cellule initiatrice doit survivre. Et pour cela : elle s’adapte grâce à des processus épigénétiques et acquiert une plasticité qui lui permet de résister et d’échapper aux systèmes de sauvegarde. « Ce processus de plasticité est connu depuis longtemps dans la formation des métastases mais, avec mon équipe, nous avons été les premiers à démontrer son implication dans la tumorigénèse », explique le Pr Alain Puisieux. « La compréhension des tout premiers évènements à l’origine du cancer est absolument primordiale car les enjeux et les perspectives sont considérables en matière de prévention, de diagnostic très précoce, avant même l’apparition des signes cliniques de la maladie, mais aussi de prise en charge thérapeutique pour nos patientes ».
Epigénétique : des travaux sur le triple négatif pour stopper le cancer au plus tôt
15 % des cancers du sein sont des cancers du sein triple négatif : ils touchent chaque année en France environ 7 500 femmes et souvent des femmes jeunes. L’une des principales caractéristiques de ce cancer est l’absence de marqueur comme cible thérapeutique, rendant particulièrement délicat le traitement. A l’Institut Curie, les travaux de l’équipe Dynamique de la plasticité épigénétique dans le cancer menée par le Dr Céline Vallot, directrice de recherche au CNRS, explore la plasticité des cellules à des stades très précoces, le rôle de l’épigénétique dans l’apparition du cancer du sein triple négatif et l’adaptation des cellules tumorales aux traitements anticancéreux.
« Avec mes collègues à l’Institut Curie, nous cherchons à établir les cartes d’identité épigénétiques de chacune des cellules, individuellement, dans une tumeur. Il s’agit d’établir les caractéristiques non pas de la séquence d’ADN elle-même mais des modifications autour de cette séquence qui influencent l’expression des gènes », explique le Dr Céline Vallot. « Pour y parvenir, nous scrutons les cellules tumorales de la glande mammaire sous le prisme du « single cell » – ou analyse en cellule unique. Grâce à cette méthodologie d’une précision extrême, nous identifions aux stades les plus précoces les profils épigénétiques responsables de leur plasticité, à savoir leur transformation de cellules saines en cellules cancéreuses. In fine, certaines modifications épigénétiques pourraient nous permettre de développer de nouveaux outils diagnostiques ou d’identifier de nouvelles cibles thérapeutiques pertinentes pour le traitement du cancer du sein triple négatif. »
Pour aller plus loin : https://images.cnrs.fr/video/7463
L’analyse en cellule unique – Single Cell : une technologie de rupture au cœur des laboratoires de l’Institut Curie
En biologie, en médecine et tout particulièrement en oncologie, l’analyse en cellule unique connait un essor considérable ces dernières années. L’Institut Curie, en pointe dans ce domaine, dispose d’une plateforme dédiée au développement des approches d’analyses de cellules uniques (Single Cell Initiative). Du fait d’une étroite collaboration entre les médecins pathologistes et les chercheurs, les cellules analysées sont obtenues à partir des prélèvements de tumeurs des patientes prises en charge à l’Institut Curie. Cette technologie de pointe permet notamment d’analyser les tumeurs à des niveaux inégalés et d’étudier l’hétérogénéité tumorale, c’est-à-dire cette capacité des cellules à s’adapter et se diversifier pendant l’évolution de la tumeur.
Grâce à l’analyse en cellule unique, les chercheurs accèdent à un champ illimité d’applications qui laissent entrevoir des avancées prometteuses, notamment en cancérologie. Etudier de plus près les transformations dans chaque cellule est un progrès majeur : la cartographie des modifications des niveaux d’ARN et de protéines, des modifications épigénétiques… permet de déchiffrer la structure d’une population cellulaire particulière, les relations d’expression génique avec différents phénotypes et l’apparition hétérogène de la différenciation. De ce fait, on peut envisager de cibler les cellules dangereuses par des traitements adaptés.
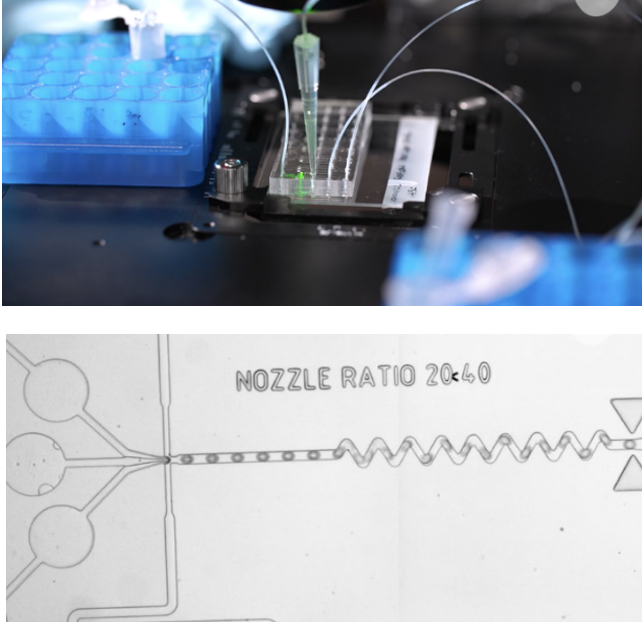
Des outils de calculs innovants et puissants
Plus concrètement, la plateforme Single cell de l’Institut Curie dispose d’une station microfluidique qui repose sur un dispositif extrêmement précis, adaptatif et évolutif. Cette technologie permet d’isoler dans des microgouttelettes plusieurs milliers de cellules individuellement. Une fois que cette encapsulation effectuée, les scientifiques sont capables de recueillir les données cellule par cellule grâce au séquençage d’ADN à haut débit et un système d’identification des cellules spécifique. Vient ensuite le travail des biologistes computationnels vont aller fouiller, analyser, modéliser ces données… afin d’identifier ces cartes d’identité épigénétiques ou génétiques et de comprendre les différences au sein d’un échantillon, leur évolution, et quelles épigénétiques qui pourraient distinguer certaines cellules plus résistantes que d’autres aux thérapies par exemple et ainsi constituer une cible thérapeutique de choix.
Défauts de réparation : quand la cellule échappe à ses propres systèmes de sécurité et devient tumorale
Dans les cellules, l’ADN est soumis continuellement à des « agressions » endogènes ou exogènes portant atteinte à son intégrité. On estime entre mille et plus d’un million le nombre de lésions par cellule et par jour. Parmi ces lésions, les cassures affectant les deux brins de l’ADN sont les plus dangereuses car, si elles ne sont pas réparées, elles donneront lieu à la mort cellulaire ou bien à des instabilités génétiques à l’origine de cancer. A l’Institut Curie, les chercheurs s’attèlent à identifier et élucider les nombreux systèmes de sécurité qui permettent en permanence aux cellules et au génome de garder leur intégrité.
Parmi ces mécanismes de protection, la cellule fait appel à la recombinaison homologue qui consiste à utiliser une copie identique (homologue) de la séquence endommagée pour copier l’information manquante. Dans ce domaine, des travaux viennent tout juste d’être publiés dans la revue Nature par l’équipe de l’Institut Curie Mécanismes alternatifs de réparation de l’ADN dans les cancers, menée par le Dr Raphaël Ceccaldi, chargé de recherche à l’Inserm. Les scientifiques viennent en effet de dévoiler un mécanisme de réparation de l’ADN jusque-là inconnu impliquant une protéine : PolꝊ, capable d’agir pendant la division cellulaire. Leurs résultats ouvrent la voie au développement de nouvelles cibles thérapeutiques pour le traitement des cancers, en particulier du sein et de l’ovaire.
Une autre équipe de l’Institut Curie – Génétique de la suppression tumorale – dirigée par le Pr Franck Toledo, professeur à Sorbonne Université, étudie quant à elle le rôle d’une protéine désormais bien connue, dénommée P53 qui – lorsque l’ADN est endommagé – sonne l’alarme et empêche la cellule de se transformer en cellule cancéreuse en induisant la mort cellulaire (apoptose) ou son vieillissement accéléré. Si la protéine P53 se trouve inactivée, l’organisme ne dispose plus de ce puissant verrou de sécurité, entrainant des défauts de réparation et une instabilité génétique des cellules qui ouvrent la voie à la progression tumorale.
Autre système de sécurité : implique des gènes qui réparent l’ADN de ses mésappariements (gènes mismatch repair). On sait aujourd’hui que la défaillance ou la neutralisation de ces gènes joue un rôle déterminant dans l’émergence de cellules cancéreuses. A l’Institut Curie, l’équipe Dynamique des chromosomes et recombinaison dirigée par le Dr Valérie Borde, directrice de recherche au CNRS, scrute les mécanismes de la recombinaison. En particulier, les chercheurs ont découvert les facteurs qui dictent le choix des sites de recombinaison le long des chromosomes, et identifié des nouveaux complexes protéiques spécifiquement impliqués dans la formation des crossing-over.
D’autres travaux menés à l’Institut Curie s’attachent à comprendre comment la séquence d’ADN cassée localise et identifie la séquence homologue parmi des milliers d’autres séquences présentent dans le noyau de la cellule (qui peut faire plusieurs microns de diamètre). Ainsi, les chercheurs de l’équipe Compartimentation et dynamique des fonctions nucléaires menée par le Dr Angela Taddei, directrice de recherche au CNRS, ont réussi à développer un outil permettant – pour la première fois – de visualiser par fluorescence chez la levure la protéine Rad51 qui impliquée dans ce phénomène d’homologie, crucial dans la réparation de l’ADN. Ces résultats ouvrent de nouvelles voies pour découvrir les facteurs génétiques et/ou des molécules permettant de réguler ce mécanisme, avec de fortes implications thérapeutiques en cancérologie. D’autres protéines bien connues : BRCA1 et BRCA2 sont également nécessaires à la réparation de l’ADN par recombinaison homologue. BRCA1 et BRCA2 sont des “gardiens” de l’intégrité du génome qui orchestrent la réparation des ADN endommagés, ce sont également les gènes mutés les plus fréquemment associés aux cancers du sein d’origine familiale, notamment les cancers du sein et de l’ovaire. Des gènes qui font l’objet de toutes les attentions à l’Institut Curie.
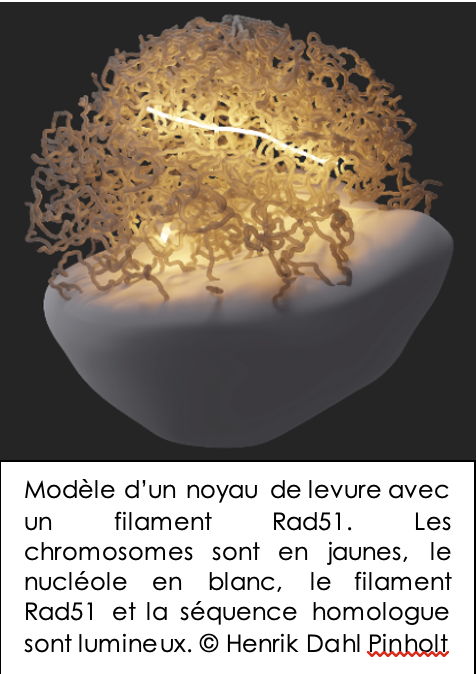
Un kit inédit pour le profilage génomique complet du cancer
Récemment, l’Institut Curie et la société Agilent ont annoncé la commercialisation d’un kit inédit d’identification des anomalies génétiques clés à l’origine des cancers, dénommé « SureSelect CD Curie CGP ». Développé par les généticiens et bioinformaticiens de l’Institut Curie en collaboration avec la société Agilent, cet outil « SureSelect CD Curie CGP » permet de réaliser, en un seul test et en peu de temps, le séquençage d’un panel de 571 gènes impliqués dans le cancer. Cela permet d’y détecter des anomalies génétiques clés mais aussi d’examiner des signatures moléculaires et des réarrangements génomiques structuraux. Objectif ? Obtenir de puissantes informations pour le diagnostic, le pronostic, la prédiction de la réponse aux thérapies ciblées, la mise en évidence de prédispositions génétiques aux cancers et la participation de patients aux essais cliniques.

Des mécanismes qui déstabilisent le génome
En dehors des défauts de réparation de l’ADN, d’autres mécanismes se produisent au cours de la transformation maligne et restent encore à explorer et comprendre. A ce titre, l’équipe Biologie des centrosomes et de l’instabilité génétique de l’Institut Curie menée par le Dr Renata Basto, directrice de recherche au CNRS, s’intéresse tout particulièrement au centrosome. Cette organelle cellulaire régule des processus très variés tels que la division cellulaire, la progression dans le cycle cellulaire, la polarité ou encore la migration. Or, des défauts du nombre ou de structure du centrosome sont associés à différents types de cancer et il est donc essentiel de comprendre leur genèse et leur conséquence.
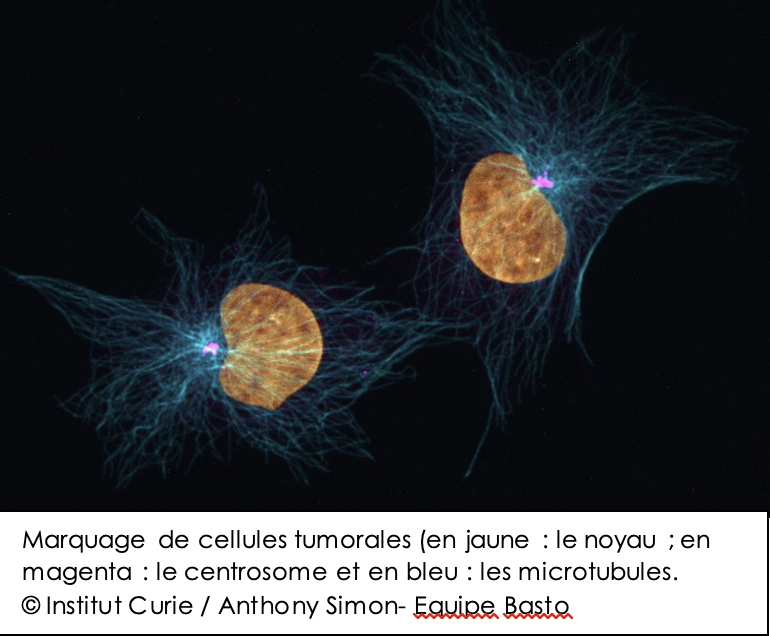
La cellule tumorale sous influence du micro-environnement
Les cellules tumorales ne sont pas isolées au sein de l’organisme. Elles interagissent avec leurs voisines, a priori saines, et c’est tout un écosystème que la cellule tumorale détourne à son avantage. Elle est en effet capable de faire croître des nouveaux vaisseaux sanguins pour subvenir à ses besoins en oxygène et en nutriments, de détourner les cellules immunitaires pour mieux se développer mais aussi d’utiliser les fibroblastes (les cellules qui forment une sorte de charpente dans tous nos tissus) pour mieux se disséminer dans l’organisme. Les scientifiques de l’Institut Curie s’attèlent à comprendre les interactions des cellules tumorales avec leur micro-environnement. En particulier, les chercheurs étudient comment les cellules cancéreuses parviennent à échapper à l’immunité, avec pour objectif de proposer des stratégies pour les contrecarrer.

Fiche 2
Les cancers du sein d’origine héréditaire
L’Institut Curie, pionnier en oncogénétique, dans la recherche et dans la prise en charge des femmes prédisposées
« Entre 5 et 10% des cancers du sein et de l’ovaire sont héréditaires. Ces cancers concernent un grand nombre de familles et nous devons mieux informer les femmes de l’existence de ces prédispositions pour améliorer le suivi des personnes à risque partout en France, rappelle la Pre Dominique Stoppa-Lyonnet, cheffe du service de génétique à l’Institut Curie et professeure à l’Université Paris-Cité. Depuis plus de 30 ans qu’existent les consultations dédiées aux prédispositions aux cancers du sein à l’Institut Curie, notre équipe a accompagné des centaines de familles. Grâce à nos échanges avec elles, à nos travaux et aux avancées de la recherche, nous observons clairement l’amélioration de la prise en charge des femmes à haut risque ».
L’existence de formes familiales de cancer du sein est connue depuis longtemps et a conduit à s’interroger sur l’existence de gènes de prédisposition. La recherche a mis en évidence progressivement à partir des années 90, plusieurs gènes dont les altérations (ou mutations) sont associées à un risque très élevé de cancers du sein et aussi de cancer de l’ovaire. Ces altérations sont, dans la très grande majorité des cas, héritées d’un des deux parents que ce soit la mère ou le père. On a tendance à oublier que les hommes peuvent être porteurs. C’est d’ailleurs quand il y a une transmission paternelle qu’il peut ne pas y avoir d’histoire familiale de cancer du sein. Les altérations de ces gènes confèrent un risque important de développer un cancer du sein aux femmes qui en sont porteuses pouvant aller jusque 70% de risque à l’âge de 70 ans, soit multiplié par 5 par rapport à la population générale.
Ce sont 5 à 10% des cancers du sein qui sont diagnostiqués dans un contexte de prédisposition génétique. Les altérations les plus fréquentes touchent les gènes BRCA1 et BRCA2. D’autres gènes de prédispositions aux cancers du sein ont été identifiés (PALB2, TP53, RAD51C, RAD51D,) mais la fréquence de leurs altération est plus faible. Si le surrisque de cancer du sein demeure, il est néanmoins variable selon le gène et est associé à un surrisque d’autres atteintes tumorales, là encore dépendant du gène.
Si la pathogénicité des altérations BRCA1 et BRCA2 confère un risque important de développer un cancer du sein, toutes les variations de séquences, ou variants, ne sont pas pathogènes. Il y a de nombreux variants de signification incertaine ou VSI. Ils rendent difficile l’estimation des risques. De nombreux efforts, nationaux et internationaux, visent à les classer en variant pathogène ou bénin.
Lorsque l’histoire individuelle ou familiale est évocatrice d’une prédisposition, il est primordial d’adresser ces femmes vers une consultation spécialisée, appelée consultation d’oncogénétique. Si au vu de l’histoire médicale familiale l’existence d’une prédisposition est probable, la réalisation d’un test génétique pour rechercher l’altération familiale est proposé. Il s’agit d’une étape indispensable qui fait appel à des technologies de séquençage de pointe, les altérations (ou variants pathogènes) étant différentes d’une famille à l’autre et les altérations possibles se comptant par centaines.
Ces tests reposent actuellement sur l’analyse d’un panel de 13 gènes de prédisposition (BRCA1, BRCA2, PALB2, TP53, CDH1, PTEN, RAD51C, RAD51D, MLH1, MSH2, MSH6, PMS2 et EPCAM) dont les altérations sont associées à un risque de cancer du sein, de l’ovaire ou pour certains de cancers de l’ovaire et du côlon. Pour autant, il faut savoir que tous les gènes de prédisposition n’ont pas encore été mis en évidence. Il arrive parfois que la fréquence des cas familiaux indique l’existence d’une prédisposition mais qu’aucun des gènes actuellement identifiés ne soit altéré dans la famille.
Si une altération d’un des gènes de prédisposition est identifiée dans la famille, le test peut alors être proposé aux autres membres (apparentés). Dans le cas où le test est positif (identification de l’altération familiale), un suivi adapté est alors mis en place, sous forme de surveillance précoce (qui peut commencer dès l’âge de 20 ans) et rapprochée par imagerie (IRM), afin de détecter le plus tôt possible la survenue éventuelle d’un cancer ou de proposer des chirurgies préventives (mammectomies prophylactiques).
Fiche 3
L’accompagnement des patientes
Les enjeux médicaux et humains de l’annonce du diagnostic de cancer du sein. Au-delà des progrès constants des équipes de recherche qui travaillent avec les médecins pour comprendre, développer et évaluer cliniquement de nouvelles stratégies thérapeutiques, les équipes de l’Institut Curie sont au plus proche des patientes pour les accompagner à toutes les étapes de la prise en charge.
Un dispositif d’annonce formalisé et organisé, partie intégrante du parcours de soins
Mis en place en 2005 dans le cadre du premier Plan cancer et en constance évolution, le dispositif d’annonce représente une grande avancée et un temps fort du parcours de soins en cancérologie. Son objectif : permettre aux patients de bénéficier des meilleures conditions d’information, d’écoute et de soutien.
Ces étapes sont cruciales pour informer le patient, répondre à ses questions et instaurer une relation de confiance avec l’équipe soignante qui déterminent l’adhésion et l’implication future du patient, avec son entourage, dans le parcours de soins et la réussite des traitements.
Les infirmières sont au cœur du dispositif d’annonce et spécialement formées. Guidées par l’empathie et l’humanité, elles interviennent après une consultation médicale au cours de laquelle un diagnostic a été annoncé ou un plan de traitement proposé. Ces temps d’échanges dédiés offrent une écoute active de la part de l’infirmière, avec une posture adaptée.
Il s’agit essentiellement de vérifier ce que les patientes ont compris de l’annonce, de répondre à leurs questions. En même temps qu’elles s’assurent de la compréhension, les infirmières évaluent leurs besoins en soins de support pour éventuellement lui proposer de rencontrer l’assistante sociale, la diététicienne, la psychologue, le gériatre, l’addictologue… et l’ensemble des professionnels des soins de support.
Soins de support : des professionnels pour aider les patientes pendant tout leur parcours
A l’Institut Curie, il n’existe pas de prise en charge de patientes atteints de cancer sans l’appui des soins de support. Leur objectif : apporter aide et soutien pendant les traitements, et ce, dès le début du parcours.
« Le DISSPO réunit plus de soixante professionnels de santé dont les spécialités sont diverses (diététicienne, kinésithérapeute, psychologue, assistante sociale, médecin et infirmier de soins palliatifs, médecin de la douleur, addictologue, etc.) et cette pluridisciplinarité permet une approche globale des patients et de leurs proches, sans oublier les patients partenaires qui ont désormais une place cruciale dans le parcours de soin des patientes », souligne la Pre Carole Bouleuc, cheffe du Département Interdisciplinaire des Soins de Support (DISSPO).
Les professionnels du DISSPO sont également épaulés par des intervenants extérieurs qui proposent des approches complémentaires et des thérapies psycho-corporelles pour lutter contre l’appréhension du risque de récidive, les troubles anxieux voire dépressifs : acupuncture, méditation de pleine conscience, EMDR, relaxation, sophrologie, hypnose, soins esthétiques… L’activité physique adaptée, couplée à la nutrition, fait également partie du plan de traitement. Des centaines d’essais cliniques lui sont consacrées, et il est prouvé qu’elle réduit de 24% le risque de rechutes dans les cancers du sein.

« L’annonce d’un cancer du sein provoque une déflagration et une détresse chez les patientes et bien souvent il existe un décalage entre la temporalité médicale et la temporalité psychique : le recours à un psychologue pour surmonter cette épreuve intervient souvent dans un second temps », précise la Pre Carole Bouleuc.
Le DISSPO propose plusieurs consultations afin de prendre en charge les femmes qui souhaiteraient disposer d’un soutien psychologique renforcé. Parce que le soin psychique participe de l’amélioration de la qualité de vie en prenant en compte les implications psychologiques de la maladie et en proposant des réponses thérapeutiques personnalisées.
L’aide psychologique pour aider à faire face
Angoissées par l’annonce ou la gravité de la maladie, touchées dans leur féminité, éprouvées sur le plan physique et psychologique par les traitements, les femmes atteintes d’un cancer du sein réagissent chacune selon leurs ressources personnelles et environnementales. La vigilance s’impose car la maladie fragilise. La détresse psychologique liée à l’annonce de la maladie s’estompe avec le temps mais peut ressurgir à n’importe quel moment du traitement. Elle peut avoir des conséquences délétères multiples, favoriser des comportements à risque et au final, constituer une perte de chance. « Certaines patientes éprouvent le besoin d’être aidées, chez d’autres la détresse peut être masquée et certaines tardent à consulter avec l’idée qu’elles vont prendre sur elles »
Les différents types de soutiens possibles s’adaptent aux besoins et peuvent être mis en place à tout moment du parcours : soutien psychologique, psychothérapique ou médicamenteux ; soutien aux proches (conjoint, enfants ou famille entière) ; groupes de paroles, dont un groupe dédié aux femmes jeunes qui ont des problématiques spécifiques. Le rôle des psychiatres et psychologues est d’accompagner les patientes dans ces moments de bouleversement et de les aider à y faire face : le bon état psychologique fait partie intégrante du traitement. Par ailleurs, la prise en compte de l’impact du cancer sur la vie intime et sexuelle est importante
Fiche 4
Les facteurs de risque du cancer du sein
Une maladie multifactorielle
Représentant 33 % des cancers féminins, le cancer du sein est le plus fréquent chez les femmes, avec 61 214 nouveaux cas en France en 2023. Il touche principalement les plus de 50 ans. Dans la majorité des cas, le développement d’un cancer du sein prend plusieurs mois, voire plusieurs années. Dépisté tôt, c’est un cancer de bon pronostic, dont le taux de survie reste stable (avec 88 % de taux de survie nette standardisée 5 ans après le diagnostic).
Le cancer du sein est une maladie multifactorielle. On connaît aujourd’hui un certain nombre de facteurs de risque du cancer du sein même s’il existe encore des incertitudes quant à l’implication et au poids de plusieurs de ces facteurs. De plus, une personne qui possède un ou plusieurs facteurs de risque peut ne jamais développer de cancer. Inversement, il est possible qu’une personne n’ayant aucun facteur de risque soit atteinte de ce cancer.
Outre le sexe (plus de 99% des cancers du sein touchent les femmes), les principaux facteurs de risque de cancer du sein sont :
- L’âge : près de 80% des cancers du sein se développent après 50 ans ;
- Les antécédents médicaux personnels et familiaux de cancers ;
- Les facteurs de risque liés à nos modes de vie tels que la consommation d’alcool et de tabac, un surpoids ou encore pas ou peu d’activité physique ;
- Certains traitements hormonaux de la ménopause.
Source Institut National du cancer :
– Facteurs de risque : https://www.e-cancer.fr/Patients-et-proches/Les-cancers/Cancer-du-sein/Facteurs-de-risque
– Panorama des cancers en France – Edition 2022
Fiche 5
Les différents types de cancers du sein
Une maladie très hétérogène et des traitements ciblés
Il n’y a pas un cancer du sein mais des cancers du sein en fonction du stade d’évolution, de la localisation dans l’organe et des cellules à partir desquelles il s’est propagé. Le cancer du sein est donc une maladie très hétérogène, associée à des caractéristiques pathologiques, histologiques spécifiques et un comportement clinique différent selon les types.
Cancer du sein in-situ versus infiltrants
On distingue le cancer du sein in situ, qui se trouve à l’intérieur des canaux ou des lobules, et le cancer du sein infiltrant, dont les cellules cancéreuses s’étendent alors aux tissus voisins, voire à d’autres parties du corps, formant des métastases.
| Anatomie de la glande mammaire normale La glande mammaire se compose principalement de lobules où est produit le lait et des canaux servant à son transport vers le mamelon pour permettre l’allaitement. Les phases initiales des cancers du sein se développent à partir des cellules épithéliales des canaux ou des lobules. Tant que les cellules cancéreuses restent confinées au niveau des canaux ou des lobules, les cancers sont dits « in situ ». En revanche, à partir du moment où les cellules cancéreuses ont traversé la membrane, dite « basale » des canaux ou des lobules et sont présentes dans les tissus avoisinants, le cancer est infiltrant. Les cellules cancéreuses peuvent se propager soit dans les ganglions situés sous l’aisselle (ganglions axillaires), soit par voie veineuse.  1. Cage thoracique – 2. Muscles pectoraux – 3. Lobules – 4. Mamelon – 5. Aréole – 6. canaux galactophores – 7. Tissu adipeux 8. Peau (Source : Wikipédia) |
Plus loin dans la classification : les cancers du sein de type luminal, basal-like, HER2, triple négatif
Tous les cancers se développent à partir des cellules épithéliales qui tapissent les canaux et les lobules du sein.
- Les cancers du sein de type luminal
Ce sont les formes les plus fréquentes de cancers du sein. Ces cancers expriment les récepteurs aux œstrogènes et à la progestérone. Ces formes comprennent deux sous-groupes selon qu’elles se multiplient peu : luminal A (25 à 40 % des cas), ou beaucoup : luminal B (20 à 25 % des cas).
- Les cancers du sein HER2 positifs : environ 15 % des cancers du sein surexpriment le récepteur HER2 à leur surface et entre donc dans la catégorie des tumeurs HER2+. Activé, ce récepteur provoque la prolifération cellulaire et sa surexpression a longtemps été synonyme de mauvais pronostic, jusqu’au jour où un anticorps* ciblant ce récepteur a été découvert : trastuzumab (Herceptin®*).
- Les cancers du sein de type basal-like et les cancers du sein triple négatif
Les cancers de type basal-like (10 à 15% des cas) ne sont pas tous triples négatifs, et réciproquement, certaines tumeurs triples négatives n’appartiennent pas à la catégorie basal-like. Ils sont très similaires aux tumeurs survenant chez les femmes porteuses de mutations de BRCA1. Les cancers du sein triple négatifs se caractérisent par l’absence de récepteurs aux œstrogènes (RO-) et à la progestérone (RP-), et par le fait qu’ils ne surexpriment pas HER2 (HER2-). Ils sont qualifiés pour cette raison de triple négatif : RO-, RP-, HER2-.
Dans 70 à 80% des cas, le cancer du sein présente des récepteurs hormonaux. On dit alors que le cancer du sein est hormonodépendant (les hormones jouent un rôle dans la prolifération des cellules cancéreuses) ou que le cancer du sein est RH+ (les récepteurs hormonaux sont présents). Dans le cas contraire, on dit alors qu’il est RH- (les récepteurs hormonaux sont absents).
Par ailleurs, le marqueur Ki-67 est testé systématiquement pour évaluer la vitesse de croissance des cellules cancéreuses. De plus, le grade (de 1 à 3, faible, intermédiaire, élevé) exprime le degré d’agressivité du cancer du sein.
ZOOM… sur des lésions à risque : de la tumeur mammaire in situ au carcinome infiltrant
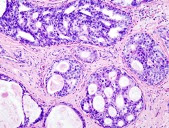
Le carcinome canalaire in situ (CCIS) représente 15 à 20 % de tous les carcinomes mammaires. On le détecte souvent lors d’une mammographie de dépistage. Les lésions de ces CCIS sont classées en fonction de la présence de nécroses, de micro-invasions et du grade nucléaire (faible, intermédiaire, élevé). Il est en effet important de connaître le grade puisque cela peut aider les médecins à prévoir la probabilité de réapparition du CCIS après le traitement ou d’évolution en cancer du sein infiltrant.
La Pre Anne Vincent-Salomon dirige le Pôle de Médecine Diagnostique et Théranostique de l’Institut Curie et mène de nombreux de travaux de recherche sur les différents types de carcinomes mammaires, en particulier les CCIS. Différentes classes moléculaires de carcinomes existent :
> les triples négatifs qui représentent 5 à 8 % des CCIS ;
> la surexpression de HER2 est plus fréquemment observée et jusqu’à 60% dans les CCIS de haut grade ;
> L’analyse des récepteurs d’œstrogènes et de progestérone n’est pas systématique en pratique clinique.
Après chirurgie et radiothérapie, le pronostic des CCIS est excellent avec un taux de mortalité de 3,7 %. Le taux de rechute est de 7 % à 5 ans et de 16 % à 10 ans. Des paramètres biologiques ont été rétrospectivement associés à un mauvais pronostic (amplification de HER2, prolifération, perte de RB, expression de COX2…).
Un essai basé sur des critères biologiques des lésions de carcinome in situ et des critères cliniques est actuellement en cours à l’Institut Curie. Appelé Romance et mené par UNITRAD/UNICANCER (France), cet essai évalue l’expression des récepteurs aux œstrogènes, l’expression du KI67 et la présence de nécroses des cellules dans les lésions de carcinome in situ sur la biopsie diagnostique. L’étude est prospective et randomisée sur l’omission de la radiothérapie du sein entier après une chirurgie conservatrice chez des patientes présentant CCIS de type luminal A à très faible risque. Le recrutement est en cours.
Les efforts de recherche s’orientent vers l’intégration de l’écosystème du CCIS (cellules myoépithéliales, stroma, cellules immunitaires et cellules carcinomateuses) afin d’identifier plus précisément le CCIS associé à une plus grande agressivité, ce qui permettrait de réaliser des essais cliniques de désescalade en toute sécurité.
Merci à l’institut Curie. N’hésitez pas à réagir sur francaises-ethniques.com et si vous êtes intéressée par une interview / visio avec des spécialiste, commentez !
A propos de l’Institut Curie
L’Institut Curie, 1er centre français de lutte contre le cancer, associe un centre de recherche de renommée internationale et un ensemble hospitalier de pointe qui prend en charge tous les cancers y compris les plus rares. Fondé en 1909 par Marie Curie, l’Institut Curie rassemble sur 3 sites (Paris, Saint-Cloud et Orsay) plus de 3 700 chercheurs, médecins et soignants autour de ses 3 missions : soins, recherche et enseignement. Fondation reconnue d’utilité publique habilitée à recevoir des dons et des legs, l’Institut Curie peut, grâce au soutien de ses donateurs, accélérer les découvertes et ainsi améliorer les traitements et la qualité de vie des malades. Pour en savoir plus : curie.fr